成人和青少年中肥胖引发的心脏代谢并发症的显著增加,对医疗系统造成了巨大负担。肥胖增加了全因死亡率的风险,部分原因是心血管并发症风险增加、代谢功能障碍相关的脂肪肝病、全身性炎症、射血分数保留的心力衰竭(HFpEF)和神经退行性疾病。这些病理状况的核心是异常能量产生和营养储存导致的心脏代谢后果,这可能干扰关键细胞过程的调节。
具体而言,糖和酮体代谢在心脏代谢疾病中发生改变,强调了底物代谢作为导致不良健康结果的因素的重要性。新兴证据表明,肥胖的心脏代谢并发症与神经退行性疾病的进展之间存在关联。这一观点得到支持,即发现神经退行性疾病与大脑葡萄糖代谢的改变有关,而生酮疗法在治疗与神经退行性疾病相关的神经系统疾病中显示了潜力。
生酮疗法可以维持神经系统的能量稳态,基于在神经系统及其他系统中的发现,它可能通过超越传统氧化作用的机制提供益处。心脏代谢疾病与神经退行性疾病之间的新兴关系可能还与底物代谢失调的后果有关。在这篇综述中,我们讨论了酮体代谢及其与心脏代谢和神经退行性疾病的联系。我们强调了酮体代谢在预防这些不良健康结果中的传统和非传统角色。
由于生酮疗法在最近的认知功能保护中的进展中已经被证明是有用的,酮体代谢可能为连接心脏代谢疾病与认知衰退风险的机制中的联系提供有价值的见解。我们具体涵盖了以下主题:
1. 生理和病理条件下的酮体代谢
2. 与神经退行性疾病和认知下降相关的心脏代谢
3. 影响酮体代谢的干预措施及其对复杂疾病的影响
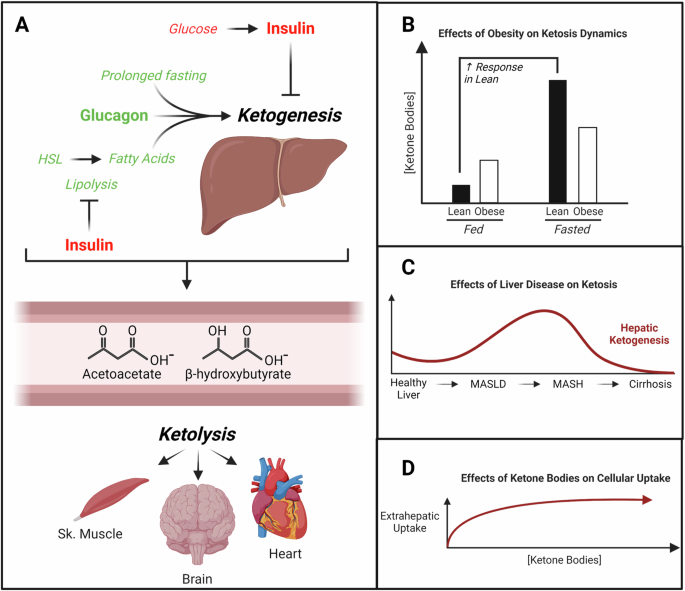
酮体乙酰乙酸(AcAc)、D-β-羟基丁酸(D-βOHB)和丙酮主要在肝细胞线粒体基质中合成,其比例与脂肪组织脂解和肝脏脂肪氧化的速率有关。
肝线粒体中3-羟甲基戊二酰辅酶A合成酶2(HMGCS2)的同工型催化酮体生成的关键步骤,将线粒体β-氧化产生的乙酰乙酰辅酶A和乙酰辅酶A缩合成HMG-CoA,然后由HMG-CoA裂解酶(HMGCL)裂解生成AcAc。AcAc可以通过单羧酸转运蛋白(SLC16A1 [MCT1] 或MCT2)进入血液循环,或通过线粒体D-βOHB脱氢酶(BDH1)在NADH依赖下还原为D-βOHB。
D-βOHB然后通过相同的转运蛋白(MCT1/2)进入循环系统。一旦进入循环,酮体通过MCT1进入肝外组织,D-βOHB氧化通过BDH1反应的逆转,重新生成AcAc和NADH。随后,AcAc通过命运决定的线粒体酶琥珀酰辅酶A:3-氧酸辅酶A转移酶(SCOT)转化回AcAc-CoA,后者在除肝细胞外的所有组织中表达,并允许肝外氧化。通过线粒体硫酰化酶的活性,肝外线粒体产生乙酰辅酶A供细胞使用。
在生理条件下,肝酮生成增加以应对碳水化合物供应的限制,例如在禁食或低碳水化合物高脂饮食时。能量消耗增加或运动后,酮生成还可以进一步加强。病理条件下,如1型糖尿病患者的糖尿病酮症酸中毒中,无限制的脂肪组织脂解产生脂肪酸酮生底物。肝酮体的生产和肝外利用由胰岛素和胰高血糖素调节,分子机制和各种转录调控也施加了额外控制。

 我我信息网
我我信息网



















